| No Time to relax
Das alternde Herz
von Carsten Tschöpe, Matthias Pauschinger &
Heinz-Peter Schultheiss
Wie alle Organe ist auch das Herz im Alter vielfältigen morphologischen und funktionellen Veränderungen unterworfen, die zu einer Abnahme der jugendlichen Belastungsfähigkeit führen. In einer zunehmend älter werdenden Gesellschaft stellt sich dem heutigen Kardiologen immer häufiger die Frage, ob das alternde Herz per se eine zu behandelnde „Krankheit“ ist und/oder ob man zwischen einem „natürlichen“ und einem „pathologischen“ Alterungsprozess unterscheiden kann.
Im Alter nimmt die Erschlaffungsfähigkeit des Herzens ab. Dies ist unter anderem von der Gefäßfunktion und dem Grad der kardialen Bildung von Bindegewebe abhängig. In der Abteilung für Kardiologie und Pulmologie des Campus Benjamin Franklin wurde ein Forschungsschwerpunkt aufgebaut, der diese Zusammenhänge analysiert. Dazu war es notwendig, ein Diagnosesystem in Form eines speziellen Konduktanzkathetersystems einzurichten, mit dem es möglich ist, die Erschlaffungsfähigkeit des Herzens in Verbindung mit der koronaren Gefäßfunktion zu untersuchen.
Außerdem ist es gelungen, Mechanismen der kardialen Kollagenbildung nach Analyse winziger Herzgewebeproben immunhistologisch und molekularbiologisch zu untersuchen.
Systole und Diastole
Im Sinne einer Saug-Druck-Pumpe gelingt es dem Herzen, Sauerstoff-angereichertes Blut in den Kreislauf auszuwerfen. Dabei kommt es in der Auswurfphase, in der Systole, zu einer kräftigen Kontraktions- und Rotationsbewegung der linken Herzkammer (Ventrikel). Bei dieser Kontraktion wird bis zu achtzig Prozent des aufgenommen Blutvolumens in den Kreislauf befördert. Anschließend muss das Herz erschlaffen (relaxieren), damit sich der linke Ventrikel wieder mit Blut füllen kann. Diese Füllungsphase wird Diastole genannt. Störungen in der Systole und/oder Diastole können zur Herzinsuffizienz führen.
Systolische Funktionsstörungen sind bisher gut untersucht, treten meist gemeinsam mit diastolischen Funktionsstörungen auf und prägen das Bild der Herzinsuffizienz. Sie können häufig durch eine Echokardiographie erfasst werden. Oft ist die Herzinsuffizienz die Folge eines Herzinfarkts, nach langjährigem unkontrolliertem Bluthochdruck oder sie tritt im Rahmen einer dilatativen Kardiomyopathie auf. Darunter versteht man die Vergrößerung einer Herzkammer, ohne eine Zunahme der Dicke der Herzmuskulatur mit einer verminderten systolischen Auswurfphase. Patienten mit Herzinsuffizienz klagen über eine Abnahme ihrer Belastungsfähigkeit, Luftnot bis hin zur Entwicklung von Lungen- und Beinödemen.
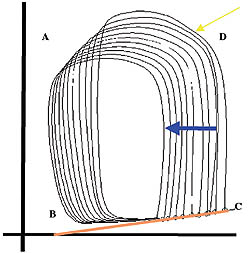
Abbildung 1: Mit dem Konduktanzkatheter kann das Arbeitsdiagramm des Herzens, das einer Druck-Volumen Beziehung entspricht, erfasst werden: In der Füllungsphase (Diastole) des linken Ventrikels (B-C) kommt es zur Volumenaufnahme, ohne dass der Druck in der Herzkammer steigt. Am Ende dieser Phase (C) - nach Schluss der Vorhofklappe - beginnt die Kontraktionsphase (Systole), die nach dem Öffnen der Aortenklappe (D) und Auswurf des Blutes in den Kreislauf (A) endet und nach einer isovolometrischen Relaxation wieder in die diastolische Phase mündet. Während einer kurzzeitigen Vorlastsenkung z. B. nach einer Vena Cava Okklusion, kommt es zu einer Linksverschiebung der Druck-Volumen Kurve (blauer Pfeil). Der Winkel der Tangente (Orange), die sich aus der Verbindung der dabei gemessen Veränderungen der links-ventrikulären enddiastolischen Drücke ergibt, stellt die enddiastolische Druck-Volumenbeziehung dar und ist ein Maß für die linksventrikuläre Steifigkeit. Dies ist die spezifischste Methode zur Beschreibung der diastolischen Funktion und eine Vorrausetzung für wissenschaftliche klinische Untersuchungen in diesem Zusammenhang.
Diastolische Herzinsuffizienz
Ältere Patienten über 65 Jahre konsultieren mit diesen Symptomen wiederholt ihren Hausarzt, ohne dass es immer gelingt, eine systolische Herzinsuffizienz, einen Herzklappenfehler, eine Lungenerkrankung oder eine Schilddrüsenunterfunktion und Fettleibigkeit nachzuweisen. Viele Hausärzte führen diese Beschwerden dann auf einen Mangel an Kondition, auf depressive Verstimmung oder auf das Alter zurück. Heute wissen wir jedoch, dass bei diesen Patienten häufig eine isolierte diastolische Funktionsstörung bei normaler systolischer Funktion vorliegt. Dabei kommt es aufgrund der gestörten Füllungsphase des linken Ventrikels zu einem Blutrückstau, der zunächst nur den so genannten kleinen Kreislauf, zu dem die Lunge gehört, kompromittiert. Dies bewirkt bei den Patienten Luftnot, die besonders unter Belastung zunimmt. Später können auch Beinödeme auftreten. Somit wird verständlich, dass klinisch gesehen eine systolische und eine diastolische Herzinsuffizienz nicht einfach voneinander zu unterscheiden sind.
Die diastolische Funktionsstörung im Alter
Das Krankheitsbild der isolierten diastolischen Funktionsstörung macht bei den 70-Jährigen 42 bis 67 Prozent der Fälle aus. Meistens haben Frauen diese Störungen, vor allem wenn sie bereits seit längerem unter Bluthochdruck leiden. (Fischer et al. 2003). Viele Patienten werden mehrfach stationär behandelt und besitzen eine niedrigere Lebenserwartung als gleichaltrige Gesunde. Das Erkennen und Behandeln dieser Erkrankung stellt deshalb gerade in einer immer älter werdenden Gesellschaft eine besondere Herausforderung dar (Vasan et al. 1995; Zile und Brutsaert 2000).
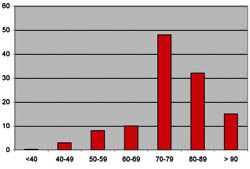
Abbildung 2: Bei über 70-jährigen Patienten nimmt die Inzidenz der isolierten diastolischen Herzinsuffizienz signifikant zu (nach: Senni et al.1998).
Mechanismen
Bislang sind die pathophysiologischen Hintergründe, die zu einer isolierten diastolischen Dysfunktion des älteren Patienten führen, noch nicht sehr gut erforscht. Sowohl bei der systolischen Herzinsuffizienz als auch bei einer isolierten diastolischen Dysfunktion kommt es zu einer nicht erwünschten Aktivierung von Hormonsystemen, die auf Dauer das Herz schädigen und zu einem unwirtschaftlichen Energiehaushalt der Herzmuskelzelle führen kann (Khan et al. 2002, Shivakumar et al. 2003). Dabei unterscheiden Mediziner zwischen einem physiologischen Alterungsprozess des Herzens und Prozessen, die aufgrund einer zusätzlichen Komorbidität zu einem übermäßigen Elastizitätsverlust des Herzens führen. Morphologisch gesehen, können in allen drei Bereichen des Herzens – den Herzmuskelzellen, dem Bindegewebe und den Gefäßen – alterstypische Veränderungen nachgewiesen werden, die zu einer Störung in der Diastole führen.
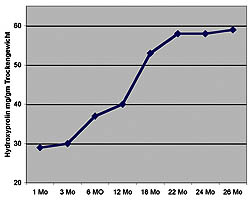
Abbildung 3: Nachweis einer altersbedingten Zunahme der kardialen Fibrose im Rattenmodell (nach Nguyen et al. 2001).
Veränderungen der Herzmuskelzellen
Bei der isolierten diastolischen Dysfunktion im Alter nimmt in der Regel die Gewebemasse des linken Ventrikels zu. Dies führt zur vermehrten Steifheit der Kammer und einer verminderten Dehnungsfähigkeit. Bei älteren Patienten trifft dies auf alle Komponenten des Herzens zu. Zwar werden die Herzmuskelzellen (Myozyten) größer, nehmen aber zahlenmäßig ab (Gazoti et al. 2001 b). Gleichzeitig ist der älter werdende Herzmuskel jedoch immer weniger in der Lage, einen schnellen, koordinierten und intrazellulären Kalziumhaushalt aufrechtzuhalten. Intrazelluläres Kalzium ist für das Zusammenziehen des Herzens in der Systole entscheidend. Das Kalzium muss aber durch eine spezielle Kalziumpumpe (Kalzium-ATPase [SERCA-2a]) wieder in die Speicherorganellen zurückgepumpt werden, damit eine Erschlaffung des Herzens in der diastolischen Füllungsphase möglich ist. Dieser schnelle und Energie verbrauchende intrazelluläre Kalziumrücktransport wird im Alter langsamer und behindert das Relaxationsvermögen des Herzens (Nguyen et al. 2001). So kommt es insgesamt zu einem Circulus vitiosus, der mit einer Abnahme der Erschlaffungsfähigkeit des Herzens einhergeht (Varagic et al. 2001).
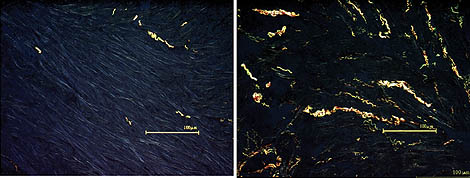
Abbildung 4: Vermehrter Kollagengehalt im Myokard als Hinweis für das Vorliegen einer möglichen diastolischen Dysfunktion
(nach: Pauschinger et al. 1999).
Veränderungen des Bindegewebes
Das kardiale Bindegewebe, die so genannte extrazelluläre Matrix, verändert sich im Alter ebenfalls, wodurch die Füllung des Herzens beeinträchtigt werden kann. Im Gegensatz zu der oben beschriebenen Zunahme der linksventrikulären Hypertrophie sind die altersbedingten Bindegewebsveränderungen viel ausgeprägter und von entscheidenderer Konsequenz für die Abnahme des (passiven) Dehnungsvermögens des Herzens.
Die Aufgabe des kardialen Bindegewebes besteht unter anderem darin, dass die Herzmuskelzellen bei ihrer Pumparbeit nicht überdehnt werden und das Organgefüge nicht auseinander gleitet. Das Bindegewebe setzt sich dabei aus kollagenartigen Fasern zusammen, die teilweise elastisch, aber auch fester als Stahl sein können.
Die Zusammensetzung der unterschiedlichen Kollagenfasern ist also entscheidend für das Dehnungsverhalten des Herzens – und somit maßgeblich für die Güte der diastolischen Funktion (MacKenna et al. 2000).
Die extrazelluläre Matrix erneuert sich im Gegensatz zu den Myozyten ständig. Hormonsysteme, wie das Renin-Angiotensin-System, können die Kollagenbildung durch Stimulation von kollagenbildenden Zellen, den Fibroblasten, erhöhen. Andere Hormonsysteme, wie das Kallikrein-Kinin-System, können dem entgegenwirken und eine überschießende Kollagenbildung ausgleichen (Tschöpe et al. 2002). Neben den Hormonsystemen ist auch die Zytokinkaskade an der Kollagen-Homöostase beteiligt (Li et al. 2002). Zusätzlich sorgen bestimmte Enzymsysteme, so genannte Matrix-Metalloproteinasen (MMP´s), dafür, dass altes Kollagen abgebaut wird. Eine Abnahme ihrer Aktivität würde den Kreislauf der Kollagenerneuerung unterbrechen.
Der Alterungsprozess des Herzens ist mit Veränderungen dieses Kreislaufs verbunden. Es kommt zu einer kardialen Fibrose, die dadurch charakterisiert ist, dass es zu einer Zunahme des stahl-ähnlichen Kollagen Typ I und zu einer Abnahme des elastischen Kollagen Typs III kommt (Gazoti et al 2001 a , b, Xu et al. 2003). Dabei scheint weniger eine gesteigerte Kollagenneubildung im Vordergrund zu stehen, als vielmehr eine Ineffektivität im Kollagenabbau. Studien zeigen, dass es im Alter zur Abnahme der MMP-2-Aktivität kommt, also zu einer Störung des Enzyms, das besonders wichtig für den Abbau von Kollagen Typ I ist (Robert et al 1997, Xu et al. 2003). Zusätzlich sind im Alter die Kollagene untereinander viel stärker vernetzt („Cross-linking“) (Nguyen et al. 2001), sodass selbst bei normaler Aktivität des MMP-Systems seine Effektivität eingeschränkt sein würde.
Die Funktion des MMP-Systems hängt unter anderem auch vom Östrogen ab, was zumindest eine Erklärung dafür sein könnte, dass im Gegensatz zu Männern besonders Frauen im Alter eine isolierte diastolische Dysfunktion entwickeln.
Gefässsystem
Auch die Gefäße unterliegen altersbedingten Umbauprozessen (Aviv et al 2001). So weiten sich die Gefäßwandmuskelzellen aus, ihre Bindegewebshülle nimmt zu. (Gale et al. 2001). Das bedingt nicht nur einen Elastizitätsverlust der großen Gefäße: Auch die kleineren Gefäßsysteme, inklusive der Herzkranzgefäße, unterliegen Veränderungen. Sie können erhebliche Konsequenzen für die Sauerstoffversorgung der davon abhängigen Organgebiete haben. Denn Sauerstoff muss in die zu versorgenden Organzellen, zum Beispiel zu den Myozyten, kommen können, was durch fibrosierte Gefäße eingeschränkt ist. Eine verminderte Sauerstoffversorgung provoziert nicht nur ein Absterben von Zellen, sondern bedingt auch die Bildung einer Ersatzfibrose. Diese führt im Hinblick auf die diastolische Funktion zu einer weiteren Abnahme der Ventrikeldehnungsfähigkeit. Aber nicht nur die Sauerstoffversorgung ist für die nie ruhende Herzmuskelzelle von einer einwandfreien Gefäßfunktion abhängig. Der von der Gefäßinnenwand – dem Endothel – gebildete Stickstoff (NO) ist ebenfalls für die Herzmuskelzelle in der Relaxationsphase entscheidend. Im Alter nimmt die endogene Stickstoffbildung ebenfalls ab, was als Konsequenz mit einer gestörten Dehnungsfähigkeit der Herzmuskelzelle verbunden ist (Abbildung 5) (Barouch et al. 2003).
Im Alter kommt es zu strukturellen Veränderungen, die die Myozyten, das Bindegewebe und die Gefäßfunktion betreffen. Diese Veränderungen führen zu einem Dehnungsverlust des linken Ventrikels und somit zur Entwicklung einer diastolischen Dysfunktion. Diese Veränderungen ähneln denen, wie sie auch für die Hypertonie und den Diabetes mellitus typisch sind und verstärken sich gegenseitig, wenn sie zusammen vorliegen.
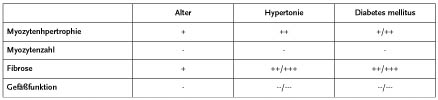
Der Alterungsprozess des Herzens lässt sich also physiologisch nachweisen, ohne dass der Mensch deshalb krank sein muss. So kann die im Alter auftretende milde Hypertrophie auch als ein Anpassungsprozess verstanden werden, bei dem es, im Gegensatz zur Hypertrophie, unter einer Bluthochdruckkrankheit nicht zu einer Erweiterung und Schädigung des Herzens kommt. Veränderungen der diastolischen Funktion nennt man – solange der Patient keine Symptome hat – „Diastolische Abnormalität“. Sie ist in der Echokardiographie leicht zu erkennen und nach heutigem Wissen ohne therapeutische Konsequenz. Sobald der Patient jedoch über klinische Symptome wie Belastungsluftnot und Beinödeme klagt, obwohl die systolische Funktion des Herzens nicht eingeschränkt ist, spricht man von einer „Diastolischen Dysfunktion“, die je nach Ursache behandelt werden kann. (Tschöpe und Schultheiss 2002). Eine diastolische Dysfunktion und/oder Herzinsuffizienz tritt zumeist dann auf, wenn weitere Erkrankungen dazu kommen wie der Bluthochdruck, ein Diabetes mellitus und/oder koronare Herzerkrankung (Fischer et al. 2003).
Diagnostik
Eine diastolische Dysfunktion kann der Kardiologe meist in der Echokardiographie nachweisen. (Zile und Brutsaert 2000). Auch durch eine zusätzliche Blutuntersuchung, mit der die Plasma-BNP-Spiegel bestimmt werden, kann das Vorliegen dieses Krankheitsbildes weiter verifiziert werden. In manchen Fällen sind invasive Untersuchungen wie ein Rechts-Linksherzkatheter oder eine Konduktanzkatheteruntersuchung nötig, wie sie in der kardiologischen Klinik des Campus Benjamin Franklin angeboten werden (Tschöpe und Schultheiss 2002). Mit Hilfe des Konduktanzkatheters sind wir in der Lage, durch die Analyse von Druck-Volumen-Schleifen das kardiale Arbeitsdiagramm exakt zu erfassen (siehe Abbildung 1). Die mit herkömmlichen Methoden nicht genau zu untersuchende diastolische Funktion kann mit der Konduktanztechnik erschlossen werden, da es mit ihr gelingt, kardiale Steifigkeitsindices zu bestimmen. Diese aufwendige Methode hat den Vorteil, dass die Erfassung der diastolischen Funktion durch Herzfrequenz- und Volumen- unabhängige Parameter erfolgt.
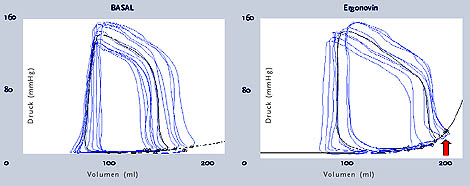
Abbildung 5: Nachweis der Bedeutung der Gefäßfunktionsstörung für die diastolische Funktion des Herzens. Unter basalen Bedingungen konnten wir eine normale systolische und diastolische Funktion bei der untersuchten 70-jährigen Patientin, die sich wegen zunehmender Belastungsluftnot bei uns vorstellte, mittels der Kondukatanzkathetermethode nachweisen. Nach Auslösen eines Koronarspasmus unter intrakoronar applizierten Ergonovin kam es zu einer Störung der diastolischen Funktion (Pfeil) bei erhaltender systolischer Funktion (Tschöpe, et al. 2004).
Therapie
Derzeit liegen noch keine Studienergebnisse über große Placebo-kontrollierte Studien zur diastolischen Herzinsuffizienz vor, so dass die Therapie bei diesem Krankheitsbild zum großen Teil noch empirisch ist (Tschöpe und Schultheiss 2002). Dennoch wissen wir, dass in der Akuttherapie durch eine so genannte Vorlastsenkung mit Nitraten und Diuretika (Wassertabletten) schnell eine Symptomverbesserung erzielt werden kann, so dass diese Medikamente auch in der (begleitenden) Dauertherapie unter bestimmten Umständen sinnvoll sind. Wenn möglich, liegt der Schwerpunkt der Therapie aber auf der Behandlung der vorliegenden Begleiterkrankungen. Es empfiehlt sich, zur Einstellung des hohen Blutdrucks bestimmte Medikamente zu verabreichen, die zusätzlich die Hypertrophie der Herzmuskelzellen vermindern und den Kollagenhaushalt normalisieren können sowie das Dehnungsverhalten und damit die diastolische Funktion des Herzens verbessern. So genannte ACE-Hemmstoffe oder AT1-Antagonisten scheinen hier sinnvoll zu sein (Charm-Studie, 2003). Auch Kalziumantagonisten können hier eine Alternative darstellen (Varagic et al. 2001).
Medikamente, die nicht nur den Blutdruck senken, sondern zusätzlich den Herzschlag verlangsamen und somit dem linken Ventrikel mehr Zeit in der Diastole zur Füllung geben (Frequenzökonomisierung), stellen ebenfalls ein sinnvolles Therapiekonzept dar. Dies kann durch Beta-Blocker oder durch Kalziumantagonisten vom Verapamil- oder Diltiazem-Typ erreicht werden. Auch sollte der Erhalt eines Sinusrhythmus angestrebt werden. Bei Diabetes mellitus sollte der Arzt darauf achten, die Blutzuckerwerte auch im Hinblick auf die diastolische Funktion gut einzustellen. Gerade die diastolische Dysfunktion ist das erste Symptom für die Entwicklung einer diabetischen Herzerkrankung und geht einer systolischen Dysfunktion meist voraus (Tschöpe und Schultheiss 2003). Aber auch die medikamentöse Behandlung der koronaren Herzerkrankung bis hin zur invasiven Revaskularisierungstherapie kann ein approbates Mittel zur Behandlung der diastolischen Dysfunktion darstellen.

|