|
Foto: Ausserhofer
Der Darm als Zielorgan für Infektionskrankheiten
Infektionen in der Gastroenterologie
Priv.-Doz. Dr. rer. nat. Dr. med. Thomas Schneider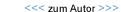
Jährlich erkranken mehr als 500 Millionen Menschen an infektiösen Durchfallerkrankungen und rund 10 Millionen sterben direkt oder indirekt an diesen Infektionen. Damit gehören Infektionen des Verdauungstrakts zu den häufigsten Todesursachen. Von den tödlich verlaufenden Infektionen sind vorwiegend Kinder, aber auch Menschen in fortgeschrittenem Lebensalter betroffen. Besonders bedroht sind immungeschwächte Patienten, deren Zahl in Deutschland ständig wächst, wie z. B. Tumorpatienten, Patienten mit transplantierten Organen, Patienten, die mit dem Immundefizienzvirus (HIV) infiziert sind, und Dialyse-pflichtige Patienten.
Diese Patientengruppen sind sehr häufig von schwerwiegenden Darminfektionen betroffen. Durch den stetig wachsenden Tourismus in ferne Urlaubsziele und die zunehmende Zahl von Einwanderern aus allen Regionen der Welt werden in Deutschland auch bisher seltene Darmerreger immer häufiger gefunden. Schleimhautoberflächen, wie sie im Darm und in den Atemwegen vorkommen, sind die wichtigsten Eintrittspforten für Infektionserreger. Der Darm bildet die weitaus größte Kontaktoberfläche mit der Außenwelt. Diese Kontaktfläche von 100-200 m2 muss zwei völlig unterschiedliche Aufgaben erfüllen. Auf der einen Seite wird die Aufnahme von Nahrungsbestandteilen sowie Flüssigkeit und die Sekretion von Enzymen, Salzen und Antikörpern ermöglicht. Auf der anderen Seite hat die Darmschleimhaut eine Barrierefunktion, die das Eindringen von Krankheitserregern verhindern soll. Zusätzlich wird in der Regel eine zu starke Immunantwort gegen Eiweißbestandteile aus der Nahrung unterdrückt (orale Toleranz). Diese sehr differenzierten und komplizierten Funktionen werden durch ein hoch spezialisiertes Immunsystem der Schleimhaut (Mukosa-assoziiertes Immunsystem) ermöglicht. Daneben sind an der Barriere auch mechanische und chemische Abwehrmechanismen beteiligt. Es ist zu erwarten, dass durch die weitere Erforschung dieses spezialisierten Immunsystems die Entwicklung von Impfstoffen gegen so verbreitete Erreger wie HIV, Rotaviren und Helicobacter pylori ermöglicht wird.
Bislang sind Kenntnisse über die Mechanismen der Abwehr von Infektionen des Verdauungstraktes trotz ihrer Häufigkeit sehr begrenzt. In der Medizinischen Klinik I (Schwerpunkte: Gastroenterologie, Infektiologie und Rheumatologie) des Universitätsklinikums Benjamin Franklin der Freien Universität Berlin bildet sich derzeit eine klinische Forschergruppe, die sich schwerpunktmäßig mit Darminfektionen und deren Behandlungsmöglichkeiten durch immunmodulatorische Therapieansätze beschäftigen wird. Es ist geplant, diesen Bereich in den Schwerpunkt „Entzündung“ an der Freien Universität Berlin mit einzubeziehen. Darüber hinaus sollen im Bereich HIV-Infektion des Gastrointestinaltraktes die wissenschaftlichen Aktivitäten in ein im Begutachtungsverfahren befindliches Kompetenznetz HIV und AIDS integriert werden. Die im Rahmen der Forschergruppeninitiative geplanten Untersuchungen umfassen ein weites Spektrum und reichen von modernen molekularbiologischen Methoden über die Zellkultur und Tierversuche bis hin zur Anwendung von optimierten immunmodulatorischen Behandlungsansätzen. Darüber hinaus sollen mukosale vorbeugende und therapeutische Impfkonzepte gegen häufige Darmerreger erprobt werden. Diese Schwerpunktbildung ist insbesondere möglich durch eine enge Zusammenarbeit mit Grundlageninstituten, wie den Instituten für Mikrobiologie der Freien Universität und der Humboldt Universität, dem Max-Planck-Institut für Infektionsbiologie sowie dem Deutschen Primatenzentrum in Göttingen, unter gleichzeitiger Mitwirkung klinischer Einrichtungen wie dem Tropeninstitut und der Ernst von Bergmann-Klinik in Potsdam. Die Initiative ist eine konsequente Weiterführung und Ausweitung der seit vielen Jahren bestehenden Forschungstätigkeit am Universitätsklinikum Benjamin Franklin auf dem Gebiet der Auswirkungen von Immundefizienzviren auf das Immunsystem, die Feinstruktur und Funktion der Dünndarmschleimhaut.
Unsere Arbeitsgruppe hat in den vergangenen Jahren wesentlich zu der Erkenntnis beigetragen, dass die Darmschleimhaut nicht nur Eintrittspforte und Manifestationsort klinischer Symptome, sondern auch ein zentrales Gewebe in der Krankheitsentstehung bei der HIV-Infektion ist. So ist kaum eine Infektionskrankheit bekannt, die in kurzer Zeit zu so einschneidenden quantitativen und funktionellen Veränderungen der weißen Blutkörperchen (Lymphozyten) in der Darmschleimhaut führt wie die HIV-Infektion beim Menschen oder die Simian-Immunodeficiency-Virus (SIV)–Infektion beim Rhesusaffen. Letztere gilt sowohl für den klinischen Verlauf als auch für die Veränderungen im Verdauungstrakt als bestes Tiermodell für die HIV-Infektion. Die Anwesenheit der Immundefizienzviren in der Darmschleimhaut kann bereits wenige Tage nach Infektion – unabhängig davon, ob der Eintritt der Viren über das Blut oder die Schleimhäute erfolgte – nachgewiesen werden (Abbildung 1).
Prof. Dr. ret. med. H.-J. Kaup, Privatzentrum GöttingenAbbildung 1: Transmissionselektronenmikroskopische Aufnahme von Immundefizienzviren (SIV) in der Darmschleimhaut.
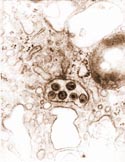
In der Darmschleimhaut werden die Immundefizienzviren vorwiegend in einer Untergruppe von Lymphozyten, den CD4-positiven Helferzellen, und in Makrophagen (Fresszellen) gefunden. Weiter konnten wir zeigen, dass parallel zur starken Vermehrung der Immundefizienzviren in der Darmschleimhaut der Verlust der wichtigen immunregulatorischen Helferzellen (CD4-positiven T-Zellen) im Darm viel früher als im Blut einsetzt und, wie wir im Tiermodell nachprüfen konnten, bereits 14 Tage nach Infektion fast vollständig ist. Diese dramatischen Störungen im spezialisierten Darmimmunsystem führen zur Ausbreitung sonst eher harmloser Durchfallerreger, wie z. B. dem Protozoon Cryptosporidium parvum (Abbildung 2). Eine solche Infektion kann schließlich zum Tode des Patienten führen. Neben diesen Infektionen im Verdauungstrakt kann es auch schon sehr früh zu Veränderungen im Aufbau der Dünndarmschleimhaut, die für die Aufnahme von Nahrungsbestandteilen verantwortlich ist, kommen. Bei Betrachtung der Feinstruktur fällt eine Abflachung der Dünndarmzotten nach HIV- und SIV-Infektion auf (Abbildung 3). Diese so genannte Zottenatrophie ist auch funktionell wirksam, da im Verlaufe der Infektion bestimmte Vitamine und Spurenelemente vermindert aufgenommen werden. Diese Beobachtungen führten zur Prägung des Begriffs der HIV-Enteropathie und könnten unter anderem den schlechten Ernährungszustand der AIDS-Patienten erklären.
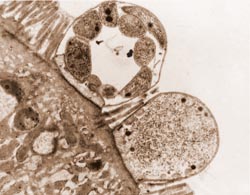
Abbildung 2: transmissionselektronenmikroskopische Aufnahme von Cryptosporidium parvum im Dünndarm eines HIV-infizierten Patienten.
Seit Mitte der 90er Jahre konnte durch die Kombination von mehreren gegen HIV gerichteten Medikamenten mit unterschiedlichen Wirkmechanismen (so genannte hoch-aktive anti-retrovirale Therapie – HAART) ein entscheidender Fortschritt in der Behandlung der HIV-Infektion erzielt werden. Dies führte zu einer dramatischen Verbesserung der Lebensqualität und der Überlebenszeit bei diesen Patienten. Die Therapie führt durch anhaltendes Unterdrücken der Virusvermehrung auch im Darm zu einer Regeneration des Darmimmunsystems und zu einer weitgehenden Wiederherstellung der Funktion und des Aufbaus der Dünndarmschleimhaut. So bewirkt die Immunrekonstitution auch eine Ausheilung von vorher nicht therapierbaren Durchfallerregern, wie zum Beispiel den Cryptosporidien (Abbildung 2). Die in Folge der Erkrankung oft ausgezehrten, stark untergewichtigen Patienten nehmen nach Einleitung dieser effektiven Therapie wieder deutlich an Gewicht und Muskelmasse zu. Leider führen Unverträglichkeit, ausgeprägte Nebenwirkungen oder Resistenzbildung nicht selten zum Abbruch oder Umstellen der Medikation. Somit gibt es noch erheblichen Forschungsbedarf, vor allem hinsichtlich einer vollständigen Immunregeneration. Auch darf trotz der erheblichen Fortschritte in der HIV-Therapie nicht vergessen werden, dass bisher noch durch keine Medikation eine vollständige Viruselimination, das heißt eine Heilung, erreicht wurde.
Bild Schneider: Abbildung 3: Struktur von Dünndarmzotten vor und nach Infektion mit Immun-defizienzviren (SIV).
Eine weitere, allerdings sehr seltene Infektionskrankheit, mit der sich die Arbeitsgruppe intensiv beschäftigt, ist der Morbus Whipple. Es handelt sich hierbei um eine Infektion mit Tropheryma whippelii, einem erst kürzlich charakterisierten intrazellulären Bakterium. Der Morbus Whipple ist eine chronische Infektionskrankheit, die sich meist bei Männern mittleren Alters schleichend über Jahre hinweg entwickelt. Die häufigsten Symptome sind Gewichtsverlust, Gelenkentzündung und Durchfall. Daneben können die Patienten aber auch durch den Befall des Zentralnervensystems mit neurologischen oder psychiatrischen Veränderungen auffallen. Da die vielfältigen Symptome auch unabhängig voneinander auftreten können, wird die Erkrankung häufig nicht erkannt und die Diagnose erst nach jahrelanger Verzögerung gestellt. Bei der Magenspiegelung fällt manchmal im Zwölffingerdarm eine schmutzig gelbliche, wulstige Schwellung der Schleimhaut auf (Abbildung 4 links: Endoskopiebild).
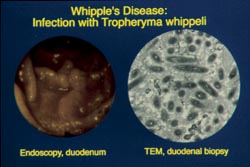
Bild Schneider: Abbildung 4. Links ein Endoskopiebild des Zwölffingerdarms, rechts eine elektronenmikroskopische Aufnahme von T. whippelii.
Die Sicherung der Diagnose erfolgt in der Regel durch eine Gewebeprobe aus dem Zwölffingerdarm, in der sich die charakteristischen, in einer Spezialfärbung nachweisbaren (periodic-acid-Shiff-positiven) Einschlüsse in Darmschleimhaut-Makrophagen finden (Abbildung 5: Histologiebild). Diese Einschlüsse entsprechen elektronenmikroskopisch charakteristischen stäbchenförmigen Bakterien (Abbildung 4 rechts: elektronenmikroskopische Aufnahme von T. whippelii). Neuere Daten weisen auf eine weite Verbreitung des Erregers in der Umwelt (z. B. im Trinkwasser und Kläranlagen) und auf eine hohe Prävalenz von ca. 30% bei gesunden Personen hin. Die Seltenheit der Erkrankung ist – bei weiter Verbreitung des Erregers in der Umwelt und offensichtlicher Harmlosigkeit bei den meisten Menschen – möglicherweise mit einem umschriebenen, genetisch determinierten Defekt der zellulären Immunität erklärbar.
In der Abwehr von Bakterien wie dem T. whippelii spielen bestimmte Botenstoffe (Zytokine), wie z. B. Interferon-g und Interleukin-12, eine wichtige Rolle, da sie Fresszellen (Makrophagen) aktivieren. In Studien aus der eigenen Arbeitsgruppe konnte eine verminderte Bildung von Interferon-g und von Interleukin-12 bei Patienten mit Morbus Whipple im Vergleich zu Kontrollpersonen gezeigt werden. Dieser offenbar sehr umschriebene Immundefekt wurde auch bei erfolgreich behandelten Patienten in gleicher Weise nachgewiesen. So scheint beim Morbus Whipple – im Gegensatz zur HIV-Infektion – der Immundefekt bereits vor der Infektion vorhanden zu sein und die Entwicklung der Erkrankung erst zu ermöglichen. Diese noch im Detail zu charakterisierende immunologische Störung hat wahrscheinlich eine defekte Phagozytose von T. whippelii (Abtötung des Erregers in den Fresszellen) zur Folge.
Aufgrund der bakteriellen Natur der Erkrankung wird der M. Whipple seit den 50er Jahren mit Antibiotika behandelt. Hierdurch kann die früher häufig tödlich verlaufende Erkrankung in vielen Fällen geheilt werden. Trotz dieses Fortschrittes gibt es immer wieder Patienten mit M. Whipple, die auf eine antibiotische Therapie ungenügend ansprechen und wiederkehrende Krankheitsschübe erleiden. Diese Patienten weisen häufig einen Befall des Zentralnervensystems auf und zeigen einen ungünstigen klinischen Verlauf, der nicht selten zum Tod führt.
Gerade diese Patienten stellen eine Herausforderung für den behandelnden Arzt dar. Die gewonnenen Erkenntnisse über immunologische Defekte eröffnen auch neue therapeutische Optionen. So könnte der Mangel an Interferon-g, das eine entscheidende Rolle bei der Abwehr solcher intrazellulärer Erreger spielt, durch einen gentechnisch hergestellten Botenstoff ausgeglichen werden.
Diese Strategie wurde von uns bei einem Patienten mit einem über 20-jährigen Verlauf eines M. Whipple angewendet. Der Patient war in den vergangenen zehn Jahren kontinuierlich mit verschiedenen Antibiotika behandelt worden und hatte zuletzt immer häufiger schwere Rückfälle (Rezidive) erlitten. Dabei war ein Befall des zentralen Nervensystems nachgewiesen worden. Dieser Patient zeigte einen günstigen Verlauf unter der Therapie mit IFN-g. Zunächst besserte sich die klinische Symptomatik, später konnte der Erreger aus dem Zentralnervensystem und dann erstmals seit Beginn der Erkrankung vor über 20 Jahren im Dünndarm eliminiert und somit eine Heilung erreicht werden. Mittlerweile wurde der Patient über drei Jahre ohne Therapie weiter beobachtet und hat bisher keinerlei Anzeichen eines Rückfalls gezeigt.
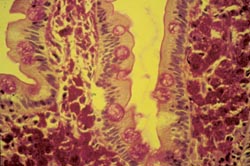
Abbildung 5: Unter dem Mikroskop kann man innerhalb der Dünndarmzotten viele rot gefärbte Strukturen erkennen, die den Bakterien (Tropheryma whippelii) entsprechen.
Die beiden vorgestellten Beispiele verdeutlichen, dass eine Infektion auf der einen Seite eine Immunschwäche auslösen kann (Beispiel: HIV-Infektion) oder auch auf der anderen Seite erst durch einen schon bestehenden Immundefekt zur Ausprägung der Krankheit führt (Beispiel: Morbus Whipple). In beiden Fällen kann man durch Medikamente die Vermehrung der Erreger unterdrücken, was bei der HIV-Infektion zur Regeneration des Immunsystems führt. Im zweiten Beispiel bleibt der Immundefekt erhalten. Da der Defekt sehr spezifisch ist, kommt es nicht zu gehäuften Infektionen mit anderen Erregern, und weil das Bakterium T. whippelii sich sehr langsam vermehrt, wird die Entwicklung einer Krankheit nach erneuter Infektion von den Patienten zeitlich nicht mehr erlebt.

|