|
Kinder beim gemeinsamen Sonnenbad zur Behandlung von Tuberkulose in der Lungenheilanstalt in St. Denis (Frankreich)
Tuberkulose
Überlegungen zur Entwicklung eines Impfstoffs
Dr. med. Timo Ulrichs
Als sich die Weltgesundheitsorganisation (WHO) und führende Vertreter aus Politik und Wirtschaft vor einem Jahr auf einen Plan zur Bekämpfung der weltweit wichtigsten Infektionskrankheiten verständigten, hatten sie vor allem die „big three“, Malaria, AIDS und Tuberkulose, im Auge. Tuberkulose ist die Infektionskrankheit mit den höchsten Zahlen an Erkrankungs- und Todesfällen und stellt nicht nur in Ländern der Dritten Welt, sondern zunehmend auch in Industrieländern ein ernstes sozioökonomisches Problem dar. Weltweit sind rund 20 Millionen Menschen an aktiver Lungentuberkulose erkrankt. Jährlich kommen etwa 8 Millionen Neuerkrankungen hinzu, also alle
4 Sekunden ein neuer Krankheitsfall. Es sterben jedes Jahr 2,2 Millionen Menschen an den Folgen der Tuberkulose. Dies entspricht der Ausrottung der Bevölkerung Berlins im Rhythmus von zwei Jahren oder einem neuen Tuberkulose-Toten alle 14 Sekunden.
Mycobacterium tuberculosis, der Erreger der Tuberkulose, wird durch Tröpfcheninfektion, das heißt durch Anhusten von an Tuberkulose-Erkrankten, verbreitet. Beengte und schlechte hygienische Verhältnisse leisten also einer Ausbreitung der Infektion Vorschub (Abb. 1). Der Erreger setzt sich in der Lunge fest, wo er von ortsständigen Abwehrzellen, den Makrophagen, aufgenommen wird. Innerhalb dieser Zellen kann M. tuberculosis erfolgreich verhindern, dass es abgetötet und zerstört wird, so dass die infizierten Makrophagen anstatt den Infektionsherd zu säubern vielmehr den Erregern als Wirtszellen dienen. Das Abwehrsystem muss sich darauf beschränken, wenigstens die Ausbreitung der Mykobakterien zu verhindern, und schottet deshalb die infizierten Makrophagen und freie Mykobakterien zum übrigen Organismus hin durch die Bildung einer bindegeweblichen Wucherung (Granulom) ab (Abb. 1). Im Granulom reagieren T-Zellen mit mykobakteriellem Antigen und aktivieren Makrophagen, die von ihnen aufgenommenen Mykobakterien an der Vermehrung zu hindern oder gar abzutöten.
Durch ein komplexes Zusammenspiel zwischen T-Zellen, Makrophagen und anderen Abwehrzellen wird so eine Immunantwort in Gang gebracht, die die Vermehrung der Mykobakterien kontrolliert und ihre Ausbreitung durch Fokussierung auf das Granulom verhindert. Es stellt sich ein dynamisches Gleichgewicht zwischen dem Erreger und dem Immunsystem des Wirts ein (Abb. 2). Kann das Immunsystem die Erreger erfolgreich im Granulom eingrenzen, beschränken sich die Mykobakterien ihrerseits darauf, in den infizierten Makrophagen die Zeit zu überdauern (zu persistieren), bis sich ihnen bei geschwächter Abwehrlage des Wirts die Möglichkeit bietet, sich wieder zu vermehren und weiter im Körper auszubreiten. Eine Schwächung des Abwehrsystems kann durch Unterernährung, andere Erkrankungen, hohes Alter, HIV und andere Faktoren zustande kommen. Besonders die rasante Verbreitung von HIV-Infektionen in Ländern südlich der Sahara und in Südostasien hat in den vergangenen Jahren die Ausbreitung der Tuberkulose erheblich gefördert. 2,7 Milliarden Menschen, also etwa jeder Dritte der Weltbevölkerung, ist mit M. tuberculosis infiziert, aber (noch) nicht erkrankt. Eine solche persistierende Infektion, die wiederaufflackern kann, schützt nicht automatisch vor einer exogenen Reinfektion mit M. tuberculosis (Abb. 1).
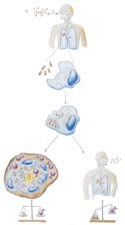
Illustrationen: Ulrichs - Abb.1: Infektion mit M. tuberculosis
(Download als PDF - Klicken Sie auf das Bild)
Glücklicherweise sind mykobakterielle Infektion und Erkrankung an Lungentuberkulose inzwischen medikamentös behandelbar. Seit der Einführung des bakteriziden Antibiotikums Streptomycins in die Therapie durch Waksman 1946 stehen wir der Tuberkulose nicht mehr hilflos gegenüber. Mittlerweile wurde eine ganze Reihe weiterer antituberkulotisch wirksamer Substanzen entwickelt. Um optimal zu wirken, müssen sie in einer Kombination aus drei (oder besser noch vier) Medikamenten über einen Zeitraum von mindestens zwei Monaten eingenommen werden, woran sich noch eine viermonatige Nachbehandlung mit zwei Medikamenten anschließt.
Die vergleichsweise hohen Kosten dieser Kombinationstherapie sowie die langwierige Behandlungsdauer stellen öffentliche Gesundheitssysteme und behandelnde Ärzte vor große Probleme. Eine unzureichende Behandlung führt beinahe zwangsläufig zur Ausbildung von multiresistenten M.-tuberculosis-Stämmen, also Mykobakterien, bei denen die verfügbaren Medikamente nicht mehr wirksam sind. Dies ist ein besonders gravierendes Problem in den überfüllten Gefängnissen in Russland und in den GUS-Staaten, wo die medizinische Versorgung gerade der Gefangenen unzureichend ist. In den USA wird seit einiger Zeit eine WHO-empfohlene Behandlungsstrategie verfolgt, bei der die Patienten täglich ihre Medikamente unter ärztlicher Aufsicht einnehmen sollen (DOT = directly observed therapy), was zu einem signifikanten Rückgang multiresistenter M. tuberculosis-Stämme geführt hat.
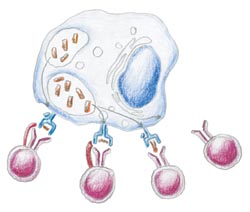
Abb.2: Immunantwort bei Infektion mit M. tuberculosis
(Download als PDF - Klicken Sie auf das Bild)
Die weltweite Verbreitung, das intrazelluläre Überleben der Erreger über lange Zeiträume in jedem dritten Menschen auf der Erde sowie die aufwendige medikamentöse Behandlung machen die Suche nach anderen Strategien zwingend erforderlich, um die Tuberkulose in den Griff zu bekommen.
Der gegenwärtig verwendete Impfstoff, die Lebendvakzine Mycobacterium bovis BCG (Bacille Calmette-Guérin), wurde von den beiden französischen Wissenschaftlern Calmette und Guérin durch eine Abschwächung von M. bovis, einem nahen Verwandten des pathogenen M. tuberculosis, hergestellt und ist seit mehr als 70 Jahren im Einsatz. Er kann eine generalisierte Tuberkulose vor allem bei abwehrgeschwächten Patienten (Miliartuberkulose) oder eine tuberkulöse Hirnhautentzündung (Meningitis) bei Kindern verhindern, schützt aber nicht vor der am meisten verbreiteten Krankheitsmanifestation, der Lungentuberkulose bei Erwachsenen. Die Datenlage zur Wirksamkeit der BCG-Impfung ist sehr widersprüchlich (0% in Indien und bis zu 80% in England). Insgesamt aber ist offensichtlich, dass die BCG-Impfung nicht merklich zur Verringerung der Neuerkrankungen oder zur besseren Kontrolle von Tuberkuloseinfektionen geführt hat. Deshalb ist sie von der Ständigen Impfkommission (STIKO) seit Mitte der 70er Jahre in Deutschland nicht mehr als obligatorische Impfung im Kindesalter empfohlen. An einen neuen Impfstoff wird die Anforderung gestellt, wirksamer als BCG zu sein und die Ausbreitung der Tuberkulose weltweit kontrollierbar zu machen. Verschiedene Ansätze, die unter anderem in Berlin verfolgt werden, sollen im Folgenden kurz vorgestellt werden.
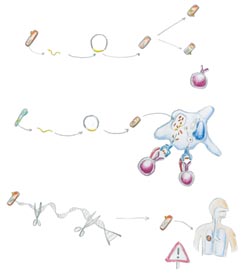
Abb.3: Strategien zur Entwicklung eines Impfstoffes
(Download als PDF - Klicken Sie auf das Bild)
Mit der Entschlüsselung des kompletten Genoms von M. tuberculosis 1998 ist es möglich, M. bovis BCG und M. tuberculosis auf genetischer Ebene zu vergleichen. Dabei hat sich herausgestellt, dass durch die Abschwächung bei M. bovis BCG viele Genregionen verlorengegangen sind, die für die oben beschriebenen Pathogenitätseigenschaften im Wirt verantwortlich sind. Diese verlorenen Genregionen kodieren aber teilweise auch für Antigene, deren Erkennung durch die Immunabwehr für eine erfolgreiche (vor Ausbreitung im Wirt schützende) Immunantwort notwendig ist. Eine mögliche Strategie, den Lebendimpfstoff BCG in seinen schützenden Eigenschaften zu verbessern, wäre daher, seinem Genom diejenigen mykobakteriellen Gene zuzuführen, die M.-tuberculosis-spezifische Antigene kodieren, ohne BCG damit virulenter zu machen. Dabei könnten entsprechende Gene entweder über ein Plasmid in BCG eingeschleust oder direkt im Anschluss an die Einschleusung in das BCG-Genom integriert werden. Die Expression der neuen Antigene durch das rekombinante BCG soll die Bildung antigenspezifischer T-Zellen fördern, die im Falle einer Infektion mit M. tuberculosis schnell aktiviert werden können (s.o., Abb. 1 und 3a).
Heute wissen wir, dass zur erfolgreichen Bekämpfung einer Infektion mit M. tuberculosis die Aktivierung einer ganze Reihe von Untergruppen antigenspezifischer T-Zellen notwendig ist (Abb. 2), die über ein komplexes System von Signalstoffen (Zytokinen) reguliert werden.
Experimente im Mausmodell haben gezeigt, dass unter ihnen auch CD8+ T-Zellen eine wichtige Rolle bei der Kontrolle der Infektion spielen. Da BCG aber überwiegend CD4+ T-Zellen aktiviert, zielt eine weitere Strategie zur Verbesserung des BCG-Impfstoffs darauf ab, die Antigenpräsentation auf infizierten Makrophagen so zu steuern, dass durch eine Immunisierung mit BCG neben CD4+ auch CD8+ T-Zellen aktiviert werden. Dazu muss BCG aus dem Phagosom (in dem es sich nach Aufnahme durch den Makrophagen natürlicherweise befindet) ins Zytoplasma gelangen können (Abb. 3b). Listeria monozytogenes, eine andere Bakterienspezies, produziert ein Enzym (Listeriolysin), das ihr ein Entkommen aus dem Phagosom ins Zytoplasma ermöglicht. Diesen Mechanismus benutzt L. monozytogenes, um von dort aus benachbarte Zellen zu infizieren. Fügt man dem BCG-Genom das Gen für Listeriolysin hinzu, kann auch BCG ins Zytoplasma der Makrophagen gelangen, das heißt, seine Antigene werden von den infizierten Makrophagen sowohl den CD4+ als auch den CD8+ T-Zellen angeboten (Abb. 3b). Diese Strategie zur Verbesserung der Antigenpräsentation BCG-infizierter Makrophagen wurde am Max-Planck-Institut für Infektionsbiologie in Berlin entwickelt und befindet sich dort in der experimentellen Prüfung.
Theoretisch wäre es einfacher, die Virulenz von M.- tuberculosis-Stämmen durch gezielte Ausschaltung von Pathogenitätsfaktoren kontrolliert zu drosseln (Deletion, Abb. 3c), ohne die Antigenität zu beeinträchtigen. Trotz der Entschlüsselung des Mykobakteriengenoms und der Fortschritte bei der Aufklärung verschiedener mykobakterieller Pathogenitätsmechanismen in den vergangenen Jahren verstehen wir aber immer noch zu wenig von der Interaktion zwischen Tuberkulose-Erreger und Immunsystem. Deshalb wäre der Einsatz einer solchen Deletionsmutante von M. tuberculosis als Lebendvakzine viel zu risikobelastet.
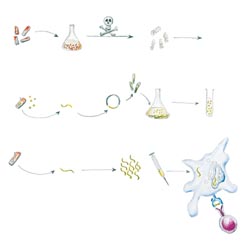
Abb.3: Strategien zur Entwicklung eines impfstoffes
(Download als PDF - Klicken Sie auf das Bild)
Ein weiterer Ansatz zur Entwicklung eines Impfstoffes wäre daher die Verwendung einer Totvakzine, also die Applikation abgetöteter Mykobakterien zum Zwecke der Impfung (Abb. 3d). Dies böte den Vorteil, dass sich unkalkulierbare Auswirkungen eines lebenden Impfstammes im Wirtsorganismus ausschließen ließen. Der Nachteil ist jedoch die wesentlich schlechtere Aktivierung der Immunabwehr durch abgetötete Erreger. Das liegt unter anderem daran, dass lebende Mykobakterien im Phagosom der infizierten Makrophagen Antigene ausscheiden, die in der frühen Phase der Infektion von T-Zellen erkannt werden können. Darüber hinaus scheint eine über lange Zeiträume vorhandene Präsenz des mykobakteriellen Impfstammes im Wirtsorganismus notwendig zu sein, um das Immunsystem besser mit den Antigenen „vertraut“ zu machen.
Diese sekretorischen Antigene, die sich nur bei lebenden Mykobakterien finden, können auch isoliert als Impfstoff verwendet werden (sogenannte Subunit-Vakzine). Ihre Gene werden in andere schnell wachsende Bakterien übertragen und dort exprimiert. Das produzierte Antigen wird anschließend gereinigt und kann dann in hohen Dosen verabreicht werden, vergleichbar den Tetanus- oder Diphtherie-Impfstoffen (Abb. 3e).
Leider wird durch ein solches Antigen nur ein vergleichsweise kleiner Teil derjenigen antigenspezifischen T-Zellen aktiviert, die für die (oben angedeutete) komplexe Immunantwort bei einer Infektion mit M. tuberculosis notwendig sind. Mit Hilfe von Vorhersageprogrammen lässt sich nach neuen Antigenen oder Antigen-Fragmenten mit Spezifität für M. tuberculosis fahnden. Die intensive Suche nach Antigenen, deren Erkennung für die Immunantwort entscheidend ist, könnte zur Entwicklung eines Kombinationsimpfstoffes aus unterschiedlichen Antigenen führen.
In jüngster Zeit haben Experimente im Tiermodell gezeigt, dass sogar die Injektion der reinen DNA, die das Gen für ein mykobakterielles Antigen enthält, zu einer Erkennung eben dieses Antigens im Wirtsorganismus führen kann. Dabei wird die in hohen Dosen verabreichte DNA von körpereigenen Zellen aufgenommen, das Gesamtprodukt an ihrer Oberfläche exprimiert und T-Zellen präsentiert (Abb. 3f). Aber auch hier wird die Effektivität einer solchen Impfstrategie durch die Aktivierung einer nur begrenzten Anzahl antigenspezifischer T-Zellen eingeschränkt.

AKG BerlinSonnenlichtheilstätte in Leysin, die der Schweizer Arzt Auguste Rollier zur Behandlung Tuberkulose-Kranker geschaffen hatte.
Anders als bei anderen Infektionskrankheiten, die nach einmaliger Erkrankung eine lebenslange Immunität hinterlassen (beispielsweise Masern oder Mumps), gewährt eine Infektion mit M. tuberculosis – wie oben erwähnt – keinen ausreichenden Schutz vor einer Reinfektion. Ein Grund dafür könnte sein, dass M. tuberculosis durch bestimmte Antigene das Immunsystem gezielt in die Irre führt und davon ablenkt, die wirklich relevanten T-Zell-Populationen zu aktivieren. Daher müsste ein neuer Impfstoff das Immunsystem gezielt aktivieren und besser für eine Infektion mit M. tuberculosis vorbereiten als die „natürliche“ Immunisierung durch eine bereits erfolgte Infektion. Da jeder dritte Mensch mit M. tuberculosis infiziert ist, sollte ein neuer Impfstoff in der Lage sein, das Immunsystem dauerhaft in die Lage zu versetzen, die im Granulom eingeschlossenen Mykobakterien in Schach zu halten und eine Lungentuberkulose sicher zu verhindern. Ein solch therapeutischer oder postinfektiöser Impfstoff ist im Falle der Tuberkulose sicherlich ein erstrebenswertes Ziel. Eine sinnvolle Kombination aus den oben vorgestellten Strategien könnte uns diesem Ziel näherbringen.
|
Glossar:
Abwehrsystem auch Immunsystem genannt, ist die Gesamtheit aller an der Immunabwehr von Mikroben beteiligten spezialisierten Zellen oder Gewebe
Antigen Molekül, das von T-Zellen über ihren für dieses Antigen spezifischen Rezeptor erkannt wird oder die Bildung spezifischer Antikörper auslöst und von diesen gebunden werden kann
CD4+ T-Zellen auch Helfer-T-Zellen genannt, erkennen über ihren T-Zell-Rezeptor ein von einer antigenpräsentierenden Zelle dargebotenes Antigen und sezernieren Zytokine, die der Zelle beispielsweise helfen, intrazelluläre Erreger abzutöten
CD8+ T-Zellen auch Killer-T-Zellen genannt, werden wie die Helfer-T-Zellen über ihren T-Zell-Rezeptor aktiviert und üben verschiedene Effektorfunktionen aus, zu denen auch das Abtöten infizierter Zellen und freier Bakterien gehört
Deletionsmutante Bakterium, dem gezielt Gene aus dem Genom entfernt oder inaktiviert wurden
DNA engl. Abk. für Desoxyribonukleinsäure, die chemische Substanz, aus denen die Gene aufgebaut sind
Expression Ablesen eines Gens und Überschreiben in das Genprodukt, ein Protein, das dann auf der Oberfläche der Zelle erscheinen kann
Immunantwort Aktivierung von Immunzellen (Makrophagen, T-Zellen etc.) nach Stimulation durch einen Erreger, die in einer adäquaten Reaktion und der Eliminierung des Erregers mündet
Lebendvakzine (meist abgeschwächtes) lebendes Bakterium, das als Impfstoff verabreicht wird, keine Krankheit auslöst, statt dessen aber das Immunsystem aktiviert und für die Abwehr einer richtigen Infektion vorbereitet
Makrophagen auch Freßzellen genannt, nehmen im Fall der Tuberkulose M. tuberculosis auf mit dem Ziel, es im Körper zu eliminieren, und präsentieren mykobakterielles Antigen an T-Zellen
Pathogenität Fähigkeit eines Erregers, Schädigungen im Organismus und eine Erkrankung hervorzurufen
Phagosom Bläschen innerhalb eines Makrophagen, das im Fall der Tuberkulose aufgenommene Mykobakterien enthält
Plasmid kurze ringförmige Sequenz DNA, die als Träger des Gens dienen kann, das man in ein Bakterium einschleusen möchte
Subunitvakzine einzelne erregerspezifische Antigene, die für sich schon eine Immunantwort hervorrufen können
Totvakzine abgetötete Bakterien, die als Impfstoff verwendet werden
T-Zellen aus dem Thymus stammende Immunzellen, die zusammen mit den B-Zellen (aus dem Knochenmark) Träger der spezifischen Immunantwort sind
Vakzine Impfstoff
Virulenz Pathogenität, Fähigkeit eines Erregers, Krankheit auszulösen
Zytoplasma Zellflüssigkeit, das die anderen Zellkompartimente (z.B. Zellkern, Phagosom etc.) umgibt
Zytokine Botenstoffe, die andere Zellen aktiveren oder hemmen können. Sie können das Immunsystem regulieren und für eine adäquate Immunantwort sorgen.
Literatur:
Übersichtsarbeiten:
Kaufmann, S.H.E., Is the development of a new tuberculosis vaccine possible? Nat.Med. 2000. 6: 955-960.
Young, D.B., Current tuberculosis vaccine development. Clin Inf Dis 2000 30(3): 254-256.
Ulrichs, T. and Kaufmann, S.H.E., Mycobacterial persistence and immunity. Front Bioscience 2002; 7: D458-69.
Bücher:
Hahn, H., Falke, D., Kaufmann, S.H.E., Ullmann, U. Medizinische Mikrobiologie und Infektiologie, 4. Auflage, Springer Verlag 2001.
Burmester, GR, Pezzutto, A. Taschenatlas der Immunologie, Thieme Verlag 1998.
Internetadressen zum Thema:
WHO: http://www.who.int/gtb
Robert-Koch-Institut: http://www.rki.de
Max-Planck-Institut für Infektionsbiologie:
http://www.mpiib-berlin.mpg.de
Institut für Infektionsmedizin der FU Berlin:
http://www.medizin.fu-berlin.de/infekt
|
 |